Elektrofil a nukleofil
Elektrofil a nukleofil jsou dvě důležité pojmy v organické chemii, které pomáhají popisovat chemické reakce mezi akceptory elektronů a dárci. Tyto dva termíny byly představeny v roce 1933 Christopherem Kelkem Ingoldem a sloužily jako náhrada za kationoidní a anionoidní termíny, které byly zavedeny v roce 1925 A.J. Lapworth.
Od té doby byly provedeny rozsáhlé studie s cílem porozumět rozdílům mezi elektrofilními a nukleofilními. Tento článek rozlišuje rozdíl mezi těmito dvěma pojmy. Stručně řečeno, nukleofil je donor elektronů, zatímco elektrofil je akceptor elektronu.
Co je elektrofil?
K rozpadu termínu je slovo "electro" z elektronů a latinské slovo "phile" znamená "milující". Jednoduše znamená, že to znamená, že milují elektrony. Jedná se o činidlo, které je charakterizováno nízkou hustotou elektronů ve vícedávkovém plášti a proto reaguje s molekulou, iontem nebo atomem s vysokou hustotou pro vytvoření kovalentní vazby. Vodíkové ionty v kyselinách a methylkaborace jsou příklady elektrofilních látek. Jsou elektrony nedostatečné.
Elektrofil je snadno detekován kladným nábojem nebo neutrálním nábojem s prázdnými orbitály (nesplňuje pravidlo oktetu). Elektrony se pohybují od oblasti s vysokou hustotou k oblasti s nízkou hustotou a na rozdíl od nábojů se navzájem přitahují. Tato teorie vysvětluje přitažlivost elektronů elektrofilními atomy, molekulami nebo ionty. Podle definice je elektrofil zaměnitelně nazýván Lewisovou kyselinou, protože přijímá elektrony v souladu s definicí kyseliny.
Reakce a níže uvedené sloučeniny ukazují příklady elektrofilů:

Při této reakci reaguje hydroxidový ion s chlorovodíkem; tak kyselina reaguje s bází. Jak je naznačeno šipkou, čím více elektonentativní atom kyslíku dodává elektronům atom kyslíku s nedostatkem elektronů. Sdílí osamělý pár s atomem vodíku, který nese pozitivní náboj ve sloučenině chlorovodíku, protože je více elektrogativní než vodík. Tato reakce je základem mnoha reakcí organické chemie, zejména reakcí Lewisovy kyseliny a Lewisovy báze. Další příklady jsou znázorněny na následujícím obrázku:
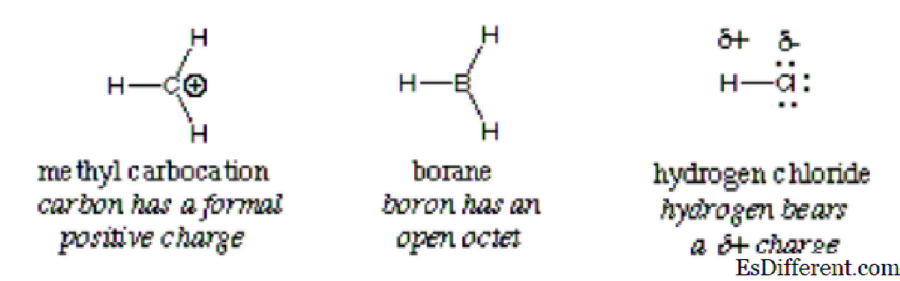
Obecně je elektrofil identifikován částečným pozitivním nábojem jako v chlorovodíku, formálním pozitivním nábojem, jako je methyl karbokace nebo volné orbitály. Polarizované neutrální molekuly, jako jsou acylhalogenidy, karbonylové sloučeniny a alkylhalogenidy, jsou typickými příklady elektrofilů.
Důležité: Hydronium ion, i když má pozitivní náboj, nesplňuje požadavky na to, aby byl klasifikován jako elektrofil, kvůli úplným prázdným orbitalům v jeho vnějším plášti. Získává ionty vodíku a vodu. Totéž platí pro amonný iont; nemá prázdné orbitály, které mohou přitahovat elektrony. Výsledkem toho není elektrofil.
Co je nukleofil?
Termín je rozdělen do slova "nucleo", který odkazuje na jádro a latinské slovo "phile", což znamená milovat. To prostě znamená, že jádro miluje. Nukleofily jsou bohaté na elektrony a jako tak dávají elektronové páry elektrofilům, které vytvářejí kovalentní vazby v chemických reakcích. Tyto látky jsou nejlépe zaznamenány osamělými páry, píky a zápornými náboji. Amoniak, jodid a hydroxidové ionty jsou příklady nukleofilních látek.
Podle definice je nukleofil zaměnitelně nazýván Lewisovou základnou, protože všichni darují elektrony a akceptují protony. Na následujícím obrázku jsou uvedeny příklady nukleofilů:

Nukleofilní centrum ve sloučenině je detekováno s nejvíce elektro-negativním atomem. Zvažte amoniak NH3; dusík je elektrogativnější a tudíž přitahuje elektrony do středu. Sloučenina má vysokou elektronovou hustotu a při reakci s elektrofilem říká voda, daruje elektrony. H2O může působit jako elektrofil nebo nukleofil v závislosti na sloučenině nebo molekule, s níž reaguje.
Zvažte obrázek níže:
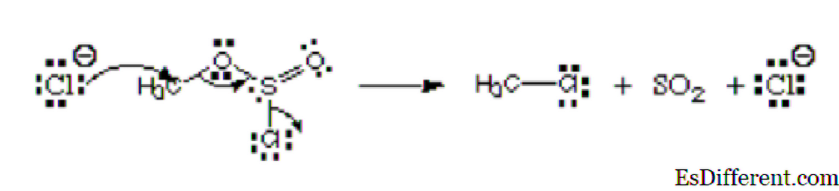
Z obrázku, první atom, chloridový ion, daruje svůj dvojitý pár uhlíku za vzniku kovalentní vazby. Má negativní náboj a daruje elektrony, a tak je považován za nukleofil. Tento atom chloru, který opouští chlorsulfitový ester, se jmenuje odstupující skupina. Není to elektrofil nebo nukleofil.
Klíčový rozdíl mezi elektrofilním a nukleofilním
Definice elektrofilu a nukleofilu
Elektrofil je Lewisova kyselina, která přijímá elektrony z atomu, iontu nebo molekuly bohaté na elektrony. Přijímáním elektronů vytváří kovalentní vazbu. Toto činidlo je často identifikováno částečným pozitivním nábojem, formálním kladným nábojem nebo neutrálním atomem, iontem nebo molekulou, která nesplňuje pravidlo oktetů. Nukleofil, na druhé straně, je atom, iont nebo molekula, která má vysokou hustotu elektronů. Přináší osamělý pár elektrofilu za vzniku kovalentní vazby. To je identifikováno kladnými náboji a volnými elektrony v jeho orbitální.
Chemické reakce elektrofilu a nukleofilu
Nukleofil je zapojen do nukleofilní substituce a adice, zatímco elektrofil je zapojen do elektrofilní substituce a přidávání.
Charge Identity v elektrofilu a nukleofilu
Elektrofil může být neutrálně nebo pozitivně nabit, zatímco nukleofil může být neutrálně nebo negativně nabitý.Elektrofile přijímá elektrony, proto se označuje jako Lewisova kyselina, zatímco nukleofil dává elektrony, proto je označován jako Lewisova báze.
Elektrofilní verše nukleofilní: srovnávací graf

Shrnutí elektrofilních veršů Nucleophile
- Elektrofil je iont nebo molekula s nedostatkem elektronů, zatímco nukleofil je atom, molekula nebo iont bohatý na elektrony
- Elektrofil může být pozitivně nebo neutrálně nabit, zatímco nukleofil může být negativně nebo neutrálně nabitý
- Elektrofil se nazývá Lewisova kyselina a nukleofil se nazývá Lewisova báze
- Elektrofile přijímá elektrony a daruje protony, zatímco nukleofil daruje elektrony a přijímá protony.




